分留による分離
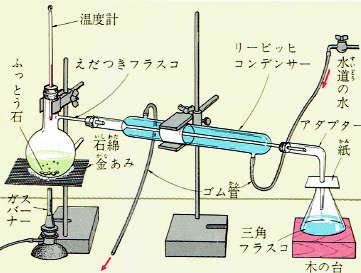
水にアルコールが混合していたりメチルアルコールとエチルアルコールが混合していたりするような液体と液体が混合している場合はそれぞれの物質の沸点の差を利用して蒸留を繰り返して分離することができます。
この方法を、分別蒸留または分留といいます。
互いに交じり合うことのできる2種類の液体AとB(例えばメチルアルコールと水)の混合液を熱するとそれらの混合の割合によって沸点が変わってきます。
例えば、純粋な水の沸点は100℃ですがこれにメチルアルコールが20パーセント混合した液は100℃よりも低い温度、約82℃で沸騰します。
さらにメチルアルコールの量を多くしていくと混合物の沸点はだんだん低くなり
ついにメチルアルコールだけになるとメチルアルコールの沸点64.7℃で沸騰するようになります。
いろいろな割合に水とメチルアルコールを混合しその沸点をはかって線で結ぶと図のような沸点曲線ができます。
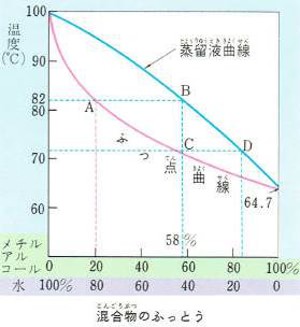
水にメチルアルコールが20パーセント混合した溶液を熱すると82℃で沸騰します(図A)。
このとき発生する蒸気を冷やすとメチルアルコールを58パーセント含んだ混合液が得られます(図B)。
メチルアルコール58パーセントの混合液を熱すると約72℃で沸騰し(図C)そのとき発生する蒸気を冷やすと約84パーセントのメチルアルコール溶液が得られます(図D)。
混合溶液には、このような特別な性質があるのでこの性質を利用して、2つの液を分離するのです。
水とメチルアルコールの混合液を熱するとはじめに蒸気となって出る部分にはメチルアルコールが多く含まれています。
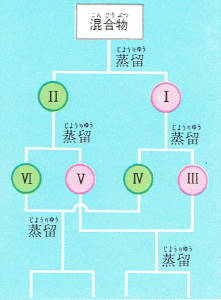
これを容器Iに取ります。最後のほうで出てくる液は、水を多く含んでいます。これを容器Ⅱに取ります。
Iの容器の液を再び蒸留してはじめに出てくる液Ⅲと、フラスコに残った液Ⅳとに分けます。
Ⅱの液も同じように、はじめに出る液Ⅴとフラスコに残る液Ⅵとに分けます。
Ⅲ液とⅤ液をいっしょにし、Ⅳ液とⅥ液をいっしょにしてそれらをまた蒸留し、前と同じことを繰り返すとメチルアルコールと水とを分離することができます。
抽出による分離
ある物質が液体に溶けているとき、その液体とは溶けあわず溶質だけを溶かす別の液体を加えて溶質だけを溶か出しあとで2つの液体を分離する方法があります。
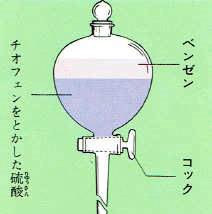
例えば、コールタールから得られたベンゼンの中にはごく少量のチオフェンという化合物が含まれています。
チオフェンは、たいへんベンゼンによく似た性質の化合物で蒸留しても取り去ることができません。
そこで、チオフェンを含んだベンゼンを分液ろうとに入れ、これに濃い硫酸を加えてよく振るとチオフェンは硫酸に溶解します。
振るのを止めて静置するとチオフェンを溶かした硫酸は比重が大きいので下の層に、ベンゼンは上の層にわかれます。
したがって、分液ろうとのコックを開いて下の層の硫酸を流し出すと、ベンゼンと分離できます。