物がよく溶けるという言い方には2通りの意味があります。
その1つは、物が早く溶けるということでもう1つは、物が多く溶けるということです。
溶解度というのは、ある物質かある溶媒にどれだけ溶解するかをあらわすものです。
ですから溶解度がわかればその物質がどれだけ溶解するかを知ることができるわけです。
ホウ酸のとけ方
ホウ酸は、雲母のような薄い感じのきらきらした無色の結晶です。
ホウ酸の溶液は、目薬・うがい薬・しっぷ薬などに使われます。
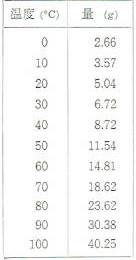
つぎの表は、いろいろな温度で100グラムの水にホウ酸がどれくらい溶けるかをしめしたものです。
この表をグラフにすると図のようになります。
このグラフを見ると、水の温度が高いほど多くのホウ酸が溶解することがわかります。
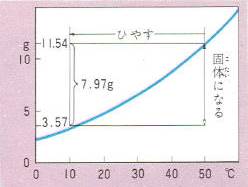
いま、50℃の水100グラムにホウ酸を溶かすと11.54グラム溶けるわけですがこの溶液の温度を10℃に下げるとどうなるでしょう。
10℃の水100グラムに溶けるホウ酸の量は3.57グラムですから11.54グラムとの差の7.97グラムはホウ酸の固体となり、溶液から分かれて沈みます。
ホウ酸の大きな粒と小さな粒の溶け方を比べると大きいものより小さいもののほうが早く溶けることがわかります。
一般に、溶質は溶媒の温度が高ければ高いほど多く、しかも早く溶けます。
また、溶質の粒が小さいほど、早く溶けます。
食塩のとけ方
食塩が水に溶けると、食塩水ができます。
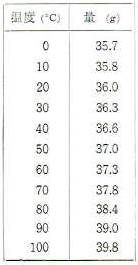
食塩の主な成分は塩化ナトリウムですが塩化ナトリウムがいろいろな温度で100グラムの水に溶ける量はつぎの表のようになっています。
いま50℃の水100グラムに塩化ナトリウムを溶かすと37.0グラム溶けます。
この溶液を、10℃に冷やすと10℃の水100グラムに溶ける塩化ナトリウムの量は35.8グラムですからその差の1.2グラムの塩化ナトリウムが溶けきれずに固体になって沈みます。
これをホウ酸のときと比べるとずっと少ない量であることがわかります。
塩化ナトリウムの溶解度をグラフにすると図のようになります。
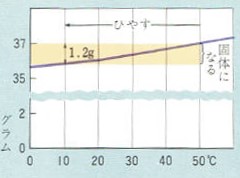
このグラフは、ホウ酸のグラフと比べると線の傾きが平らになっています。
この線の傾きが小さいのは温度の変化による溶解度の変化が少ないことをあらわすのです。
その反対に、グラフの線の傾きが大きいのは温度の変化による溶解度の変化が多くなることをあらわします。
水酸化カルシウムの溶け方
水酸化カルシウムは消石灰ともいわれ運動場などに白線をひくときに使われる白い粉です。
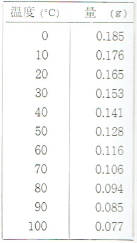
一般に、溶媒の温度が高いほど溶ける溶質の量が多くなりますが水酸化カルシウムの場合は、これと反対で水の温度が高くなるほど、溶ける量は少なくなります。
水酸化カルシウムが、いろいろな温度で水100グラムに溶ける量は、表のようになります。
この表からもわかるように水酸化カルシウムに、ホウ酸や塩化ナトリウムよりも溶解度が小さくしかも、溶媒の温度が高くなるほど小さくなっています。
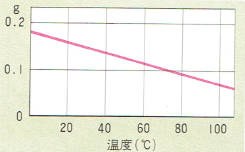
この表をグラフにすると左のようになります。
このグラフは、ホウ酸や塩化ナトリウムのグラフと違って右のほうが左のほうより下がっています。
また、溶解度の変化が非常に小さいので、これまでのグラフと違って溶質の量をあらわすたての目盛りを、ずっと引き伸ばしてあります。


