これまで、いろいろな酸や塩基についてその性質や用途を調べてきましたがここでは、酸と塩基がおこす中和反応や中和によってできる塩についてもっとくわしく調べてみましょう。
塩酸と水酸化ナトリウムの中和
うすい塩酸とうすい水酸化ナトリウム水溶液でつぎのような実験をしてみましょう。
実験
まずビーカーにうすい塩酸を10立方センチぐらい入れこれにうすい水酸化ナトリウム水溶液を少しずつくわえていきます。
水酸化ナトリウム水溶液を少し入れるたびに、青色リトマス紙を使ってこの液が酸性か塩基性かを調べます。
この液は、水酸化ナトリウム水溶液をくわえるにしたがってだんだん酸性が弱くなり、ついには、青色リトマス紙では、色がかわらなくなり赤色リトマス紙が青くかわるようになります。
今度は、うすい塩酸を少しずつくわえながら赤色リトマス紙で試します。
赤色リトマス紙を使っても、青色リトマス紙を使っても紙の色がかわらなくなったら液が酸性でも塩基性でもなくなったわけです。
この実験で、塩酸と水酸化ナトリウムの順序を加えても結果は同じです。
このように、酸と塩基が作用しあってお互いの性質を打消しあうような反応を中和反応といいます。
中和反応は、塩酸と水酸化ナトリウム水溶液の場合だけでなくいろいろな酸と塩基のあいだでもおこります。
中和の仕方
中和について考えるまえに、もういちど酸と塩基の性質を思いだしてみましょう。
酸とは、水素イオンをつくりだす物質であり酸性とは、水素イオンがもっている性質です。
塩基とは、電離によって水酸イオンをつくりだす物質であり塩基性とは、水酸イオンのもっている性質です。
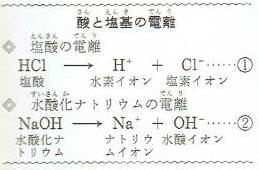
塩酸は、水とはたらきあって、左の①式のように、完全に電離して水素イオンと塩素イオンに分かれています。
また、水酸化ナトリウムも、水の中ではほぼ完全に電離して②式のようにナトリウムイオンと水酸イオンとに分かれています。
そして、塩酸に水酸化ナトリウム水溶液をくわえていると塩酸が電離してできている水素イオンと水酸化ナトリウムが電離してできている水酸イオンがむすびついて上の式のように水ができます。
ですから塩酸の中の水素イオンは水酸化ナトリウム水溶液によってできた水酸イオンの数だけ減り溶液の酸性は、だんだん弱められていきます。
もし水酸化ナトリウムの溶液をさらにくわえていくと水素イオンよりも水酸イオンの数のほうが多くなって水素イオンの性質はうちけされ、水酸イオンの性質だけか残ります。
そのため、溶液は塩基性をしめすようになります。
水酸化ナトリウムの溶液に、塩酸を入れていく場合にも水酸イオンと水素イオンの反応によって水ができます。
水酸化ナトリウム水溶液の水酸イオンは塩酸の水素イオンの数だけ減って、塩基性は弱められついには、水素イオンの数のほうが多くなって酸性をしめすようになります。
したがって中和ということは、つぎのようにいいあらわすこともできます。
中和とは、酸と塩基がはたらきあい水素イオンと水酸イオンがむすびついて水にかわるために、お互いの性質を打消しあうことです。
つまり、中和は、酸と塩基とが、直接はたらきあうのではなく酸が電離してできた水素イオンと塩基が電離してできた水酸イオンが反応して水になる変化なのです。
このとき、水素イオソの相手だった酸の陰イオン(塩酸の場合には塩素イオン)と水酸イオソの相手だった塩基の陽イオン(水酸化ナトリウムの場合にはナトリウムイオン)は、そのままなんの変化もせずに、水溶液中に残ります。
つまり、中和が進むにつれて、この溶液は塩化ナトリウム(食塩)の水溶液と同じ成分になっていくわけです。
ですから、塩酸と水酸化ナトリウムの水溶液とを塩素イオンとナトリウムイオンとがちょうど同じ数だけ残るようにまぜあわせると塩化ナトリウムの水溶液になってしまいます。
このように混ぜ合わせることを塩酸と水酸化ナトリウムを当量に使って中和したといいできた塩化ナトリウムを塩といいます。


