電解質
陽イオンや陰イオンがどのような仕組みになっているかは今までの説明でわかったことと思います。
ところでみなさんは+電気と-電気が引きあってくっつこうとすることは知っているでしょう。
陽イオンと陰イオンもそれぞれ+電気と-電気をもっているのですからお互いに引きあってくっつきます。
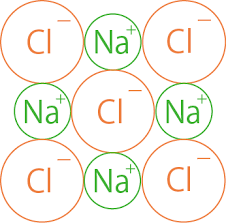
例えば、+電気をもっているナトリウムイオンと-電気をもっている塩素イオンとは水溶液でないときは、お互いにくっついて、塩化ナトリウムという化合物になります。
このようにしてできている化合物は塩化ナトリウムのほかに塩化第二銅や硫酸アンモニウムなど、たくさんあります。
このような化合物は、水に溶かすと水のはたらきによってまた陽イオンと陰イオンとに分かれてしまいます。
ある物質が水に溶けてその成分の陽イオンと陰イオンとに分かれることを電離といいます。
電離するような物質の水溶液は電流をよく導き電流によって電気分解される性質があるので水に溶けて電離する物質のことを電解質といいます。
非電解質
電解質の水溶液がよく電気を導くのにたいして砂糖の水溶液は電気を導きません。
純粋な水もほとんど電気を導きませんがそれは、これらの液の中にイオンがないから電気を導かないのです。
つまり、砂糖も水も電離しにくいわけです。
水に溶けてもイオンを生じない物質は電気を通しませんし電気分解されることもありません。
それで、このような性質をもった物質を非電解質といいます。
このように、その水溶液が電流を通すか、通さないかによって物質を電解質と非電解質とに分けることができますが物質の種類によっては、どちらともつかない中くらいに電離するものもあります。
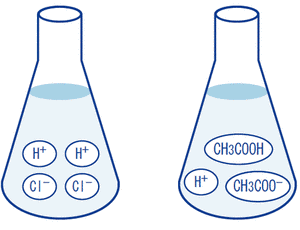
例えば、酢酸の水溶液が電気を導く程度は塩化ナトリウムの水溶液に比べると悪いですが砂糖の水溶液よりは、電気をよく導ききます。
これは、酢酸の水溶液中で酢酸は完全には電離せずほんの少ししか電離していないためです。
このような電解質を弱電解質といいます。
これにたいして、塩化ナトリウムのように水に溶けて、完全に電離してしまうような電解質のことをとくに、強電解質といいます。
また、水の分子も極めてわずかですが電離しています。
つまり、水分子1千万個について1個のわりで電離しています。
この程度では電気を導くことはほとんどできません。
しかし、水のこのわずかの電離によってできた水素イオンが電気分解のときなどには大切なはたらきをしています。