陽イオンと陰イオン
原子核のまわりをまわる電子は、いくつかの層をつくって規則正しく原子核のまわりをまわっています。
この層は電子殻とよばれています。
下の図では、ナトリウムと塩素とアルゴンとネオンの原子内の電子のありかたとナトリウムが陽イオンを、塩素が陰イオンをつくるしくみを、模型的にしめしました。
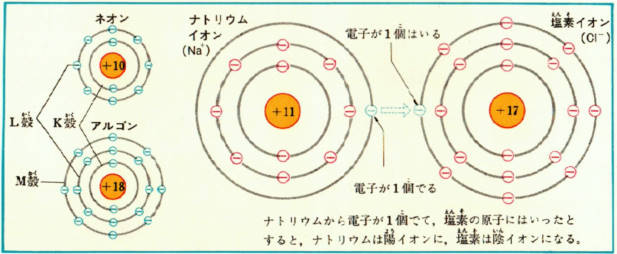
いちばん内側のK殼には2個、つぎのL殼には8個、3番目のM殼には18個の電子が入れますが、それより多くの電子は入れません。
原子内の電子は、内側の殼からつぎつぎといっぱいにしていきます。
原子の化学的性質は、いちばん外側の殼に何個電子があるかで決まります。
原子のいちばん外側の殼が電子で満たされているとき原子はいっぱんに安定で、他の元素と化合しません。
そのため電子2個をもつヘリウム、電子10個をもつネオンはK殼・L殻がそれぞれ電子で満たされますから安定です。
3番目のM殻までいっぱいになるには、28個の電子が必要なわけですがここでは、中間の18個の電子で、安定な原子アルゴンができます。
こうして電子11個で中性原子をつくるナトリウムはいちばん外側の電子1個を失って、安定なネオンの構造をもつ陽イオンとなります。
反対に塩素は外から電子1個をもらって陰イオンとなり安定なアルゴンの構造をもとうとします。
電子1個をもつ水素が、その電子をだして陽イオンとなり電子8個をもつ酸素が電子2個をもらって陰イオンとなるのもみな同じように説明されます。
塩化ナトリウム(食塩)とはナトリウムの陽イオンと塩素の陰イオンが電気的にむすびついたものなのです。
固体金属中の電気の流れ
固体金属では、原子は規則正しいならび方をして、結晶をつくっています。
しかも、金属原子内のいちばん外側をまわっている電子は自分が属している原子のそばを離れて、自由に運動しているのです。
このような電子を自由電子と言います。
自由電子を別にすると、結品をつくっている金属原子はみな陽イオンになっていると考えることができます。
ですから、規則正しくならぶ陽イオンの海の中を自由電子が勝手に動きまわっているというのが金属の原子的模型です。
金属に電圧をかけると自由電子は陽極側に引っぱられていきこれが金属に電気が流れるということです。
金属を流れる電流とは-電気をもった電子が陰極から陽極にむかって流れることで+電気が陽極から陰極に流れるのではありません。
気体中での電気の流れ
気体中の電気の流れには、いろいろなものがあります。
しかし、いずれにせよ、気体の陽イオンや電子の流れがこの電流の原因であることは、真空放電で見られる、陰極線や陽極線で明らかです。
気体の中には宇宙線などのために、いつもわずかの気体イオンと、電子が生じています。
そして、気体放電の主役を果たすのは電子です。
高い電圧のために加速された電子が、気体分子から電子をたたき出して陽イオンにしはじめるようになると、電子の数はねずみ算式に増えるので電流も急に大きくなります。
さらにできた陽イオンが陰極にあたって陰極から電子がでるようになれば、電流はまた増えます。
液体を流れる電気
液体の中には、希塩酸や食塩水のように電気をよく通すものと、蒸留水や砂糖水のように電気を通さないものがあります。
電気を通す液体を電解質溶液と言い、電気を通さない液体を非電解質溶液と言います。
電解質溶液が電気を通すのは、+電気をもった粒(陽イオン)が陰極に+電気を運び、-電気をもった粒(陰イオン)が陽極に-電気を運ぶためだということはファラデーが明らかにしました。
しかし、食塩のような電解質物質は、電圧をかけなくても水に溶かすだけでイオンにわかれてしまうことはスウェーデンのアーレニウスがはじめて明らかにしたのです。
たとえば、塩酸は水素の陽イオンと塩素の陰イオンにわかれます。
式で書くと、
HCl(塩素)
→H+(水素イオン)+Cl–(塩素イオン)です。
この希塩酸に2つの電極を入れて、直流電圧を加えると、Cl–は陽極にいき極板に-電気をあたえ、自分は塩素ガスとなって出ていきます。
そして、H+は陰極にいき、極板から-電気をもらい自分は水素ガスとなって出ていくのです。
このように、電解質溶液に電流を流してその液体を化学的に分解することを、電気分解(電解)と言います。
食塩水の場合は、もう少し複雑です。
このときは、食塩と水の一部は、つぎの式のようなイオンをつくります。
NaCl(食塩)
→Na+(ナトリウムイオン)+ Cl–(塩素イオン)
H2O(水)
→H+(水素イオン)+ OH–(水酸イオン)
Na+とH+は陰極のほうへいき、陰極からは水素ガスが出てきます。
Cl–とOH–は陽極のほうへいき、陽極からは塩素ガスが出ていきます。
こうして、陰極の近くの液をにつめると、固体の水酸化ナトリウムがえられます。
しかし、実際には、この水酸化ナトリウムはさらに塩素と化合して別の化合物にかわりますから、食塩水の電解で水酸化ナトリウムをえるにはいろいろ工夫が入ります。