鉛の製法
鉛の鉱石には、方鉛鉱や、白鉛鉱・硫酸鉛鉱などがありますがふつう鉛の製造には方鉛鉱が使われます。
方鉛鉱を、空気中で500~600℃ぐらいに焼くとその一部が左の式①・②のように変化して酸化鉛や硫酸鉛になります。

つぎに、空気を通さないで強く熱すると酸化鉛や硫酸鉛が変化しないで残っていた方鉛鉱に③・④式のように反応して、鉛ができます。
こうしてできた鉛は、まだ不純物をたくさんふくんでいますのでつぎのように精製します。
不純物のなかで、ヒ素・アンチモン・亜鉛などは鉛より酸化されやすいので空気中で600~1000℃ぐらいに数時間熱すると、酸化物となって取り除かれます。
また、いろいろなナトリウム塩とまぜて溶かすと不純物はナトリウムと化合して取り除かれます。
また、もっと純粋な鉛が必要なときには電気分解によって精製します。
鉛の性質
鉛は、青白色のつやのある重い金属で、非常に柔らかく、ナイフで切ることができます。
しかしアンチモンやヒ素などの不純物がまじると、硬くなります。
鉛は空気中におくと、すぐくもってきます。
このくもりは鉛のさびで、このさびが表面にできると、内部を保護します。
また、鉛を熱すると段々赤色になります。
これは鉛が酸化されて一酸化鉛・四三酸化鉛などの酸化鉛ができるからです。
鉛は、塩素や硫黄などとは、高温のもとに反応してそれぞれ、塩化鉛・硫化鉛をつくります。
また、うすい酸には溶けませんが、硝酸や濃硫酸には溶けます。
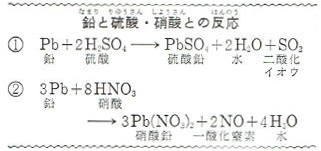
たとえば、硫酸とは二酸化硫黄を発生して硫酸鉛になります。
硝酸との反応は複雑ですが、おもな反応は、②式のようなものです。
しかし、濃硝酸には溶けません。
これは、鉛の表面に硝酸鉛ができて、これが濃硝酸には溶けにくく内部を保護するようになるからです。
鉛の用途
鉛は、スズ・アンチモン・ビスマスなどと、いろいろな合金をつくるので合金として非常に広い用途があります。
鉛そのものも、広く使われています。
たとえば、鉛は空気や水には、おかされにくいし、柔らかくて曲げやすいので水道管やガス管に利用されます。
また、放射線を通しにくい性質があるので放射線遮閉材料としても使用されます。
化学薬品をいろいろ取り扱う、実験室の流しにも鉛板をはっておくと、おかされることがありません。
そのほか、鉛蓄電池の製造にも使われています。


