石灰石の性質
石灰石は、おもに炭酸カルシウムからできています。
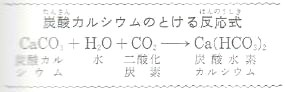
炭酸カルシウムは、純粋な水には溶けませんが二酸化炭素をふくんだ水には図の式のように反応して炭酸水素カルシウムになり、溶けます。
このため、二酸化炭素をふくんだ水が石灰岩のわれめを通るとこの反応によって石灰岩が溶け、長いあいだに、大きな洞穴になります。
これを石灰どう(鍾乳洞)といいます。
石灰どうでは、天井から炭酸水素カルシウムをふくんだ水がおちるとき途中で水分や二酸化炭素が逃げて、まえと逆の変化がおきます。
こうして、炭酸カルシウムができてかたまり、長いあいだに、つららのようになります。これを鍾乳石といいます。
水が地面に落ちてから同じような変化がおこると下からのびて、たけのこのようになります。これを石筍といいます。
石灰石(炭酸カルシウム)を熱すると、二酸化炭素を発生して生石灰(酸化カルシウム)ができます。
この生石灰を水に溶かすと、消石灰(水酸化カルシウムとなります。
また石灰石(炭酸カルシウム)は、酸と反応して二酸化炭素を発生し、その酸の塩となります。
石灰石の用途
石灰石は、生石灰・消石灰の原料になるほか、ガラス・セメントの原料にもなります。
また、鉄や銅の冶金で炉の材料や原料中にふくまれる二酸化ケイ素を取り除くためにも使われます。
炭化カルシウム
炭化カルシウムには、力ーバイドともいわれます。
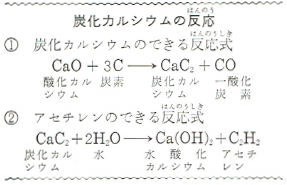
酸化カルシウムと炭素(コークス・木炭をまぜて電気炉で2300℃ぐらいに熱すると、図の①式のような反応で、炭化カルシウムができます。
純粋な炭化カルシウムは、白くてにおいがありませんがふつうは不純物をふくんでいるので、灰色でいやなにおいがあります。
炭化カルシウムは水と反応して②式のようにアセチレンを出します。
アセチレンは燃えやすい気体で灯火用や高熱発生用の燃料として使われるほか
合成繊維や合成樹脂の原料としてなくてはならないものです。

また、炭化カルシウムを電気炉で1000℃ぐらいに熱し、これに窒素をおくると、図のような反応で石灰窒素(カルシウムシアナミドと炭素の混合物)ができます。
この方法は、空気中の窒素の利用法として非常に大切です。
石灰窒素は窒素肥料として使われるほか、カルシウムシアナミドは硫酸アンモニウム・尿素・グアニジンなどの原料として重要です。


