アンモニアの水溶液
アンモニアは、20℃での水に、水の700倍ぐらいの体積が溶けます。
アンモニアの水溶液に、青色リトマス紙と赤色リトマス紙を入れると二酸化炭素の水溶液の場合と違って赤色リトマス紙は青くなりますが青色リトマス紙は色がかわりません。
一方、乾いたアンモニアの気体の中に青色リトマス紙と赤色リトマス紙を入れてみるとどちらも色がかわりません。
しかし、この場合でも、リトマス紙が水分を吸っていたりアンモニアがよく乾いていないで、水分をふくんでいたりするとアンモニアの水溶液のときと同じように赤色リトマス紙の色が青くかわります。
これは、アンモニアの気体がアンモニアやリトマス紙にふくまれる水分といっしょになってアンモニアの水溶液と同じはたらきをするからです。
アンモニアは水に溶けると、水と反応して、下の式のように、アンモニア水ができるのです。
この実験で乾いたアンモニア(水酸化ナトリウムか水酸化カリウムを詰めた瓶の中を通す)には、乾いたリトマス紙の色をかえるはたらきがなく水に溶けてアンモニア水になると、赤色リトマス紙の色を青色にかえるはたらきをもつようになることがわかりました。
アンモニア水のよに、赤色リトマス紙の色を青色にかえる物質を塩基またはアルカリといいます。
また、塩基のもっている性質を塩基性といいます。
塩基の電離
アンモニアが水に溶けると、アンモニア水ができ塩基のはたらきをしますがアンモニア水そのものが塩基のはたらきをしめしているのではありません。
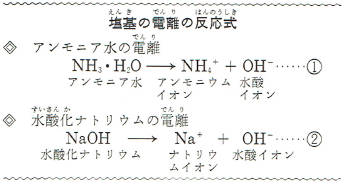
アンモニア水の一部は、左の①式のように変化しアンモニウムイオンと水酸イオンとに分かれています。
同じように、水酸化ナトリウムが水に溶けるとそのほとんどが上の②式のようにナトリウムイオンと水酸イオンとに分かれます。
このように、塩基がアンモニウムイオンやナトリウムイオンのような陽イオンと陰イオンである水酸イオンとに分かれることを、塩基の電離といいます。
塩基のはたらきをするのはアンモニア水や水酸化ナトリウムのものではなくてこれらが電離してできる水酸イオンなのです。
電離してできる陽イオンは、塩基のはたらきには直接関係しません。
したがって、塩基と塩基性ということを水酸イオンを使っていいあらわすと塩基というのは、電離によって水酸イオンをだす物質のことで塩基性とは、水酸イオンのもつ性質であるということができます。
塩基とアルカリ
水溶液の中で電離して、水酸イオンをだす物質を塩基といいましたが、アルカリともいいます。
アルカリというのは、塩基のなかでもよく水に溶け強い塩基性(アルカリ性)をしめす物質をさします。
ふつう、ナトリウム・カリウムなどのアルカリ金属の水酸化物やカルシウム・バリウムなどのアルカリ土類金属の水酸化物例えば水酸化ナトリウムや水酸化バリウムなどを、アルカリといっています。
突然には、アルカリ・アルカリ性というかわりに塩基・塩基性という言葉を使います。
塩基の性質
塩基は、水酸イオンをだす物質です。
ですから、いろいろな塩基は水酸イオンの性質を共通にもっているわけです。
つまり塩基に共通した性質は、水酸イオンの性質ということになります。
水酸イオンのおもな性質は、つぎのとおりです。
① 塩化鉄・硫酸銅のような重金属の塩の水溶液から
よく水酸化物をつくります。
これは、水酸イオンが、金属の陽イオンと反応して水に溶けにくい水酸化物をつくるからです。
② リトマスのような指示薬に、塩基性特有の色をつけます。
③ 酸と中和反応をおこします。