塩の代表的なものは塩化ナトリウム(食塩)です。
塩化ナトリウムは海水中に無尽蔵といってもよいほどふくまれています。
それで塩化ナトリウムを原料としていろいろなナトリウム塩や薬品が製造されています。
そのうち、水酸化ナトリウム・炭酸ナトリウム・炭酸水素ナトリウムはとくに重要でこの3つをソーダとよびこれらを製造する工業をソーダ工業とよんでいます。
ここでは、炭酸ナトリウムと炭酸水素ナトリウムについてその製法や性質などを調べてみましょう。
炭酸ナトリウムの製法
炭酸ナトリウムの製法には、18世紀の終わり頃にフランスのルブランが考え出したルブラン法と19世紀の中頃にベルギーのソルベーが発明したアンモニアソーダ法とがあります。
ルブラン法は、歴史的に有名なだけで今では使われていません。
現在では、アンモニアソーダ法が重要な方法として使われています。
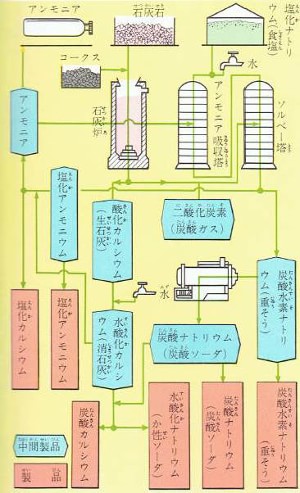
アンモニアソーダ法は、図のような装置で行われます。
まず、石灰炉に石灰石とコークスを入れコークスを燃やして石灰石を強く熱するとつぎの①式のように生石灰と二酸化炭素とができます。
でてきた二酸化炭素は、炉の上部からパイプで導き出してソルベー塔に送ります。
また、生石灰は炉の下部から取り出し水を加えて石灰乳をつくります。
いっぽう、アンモニア吸収塔に濃い食塩水を入れこれにアンモニア発生塔でつくったアンモニアガスを通し食塩水に充分吸収させて飽和させます。
このアンモニアを飽和した濃い食塩水をソルベー塔に入れます。
この中では上からアンモニアをふくんだ食塩水をおりてきて下から上がってきた二酸化炭素と反応して、まず②式のように、炭酸水素アンモニウムができます。
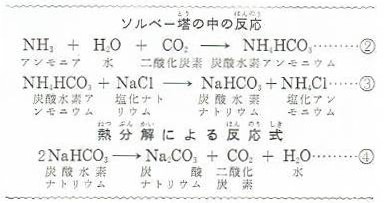
つぎに、この炭酸水素アンモニウムが食塩水と反応して③式のように、炭酸水素ナトリウムと塩化アソモニウムができます。
炭酸水素ナトリウムは、食塩水に非常に溶けにくいので、この反応でできた炭酸水素ナトリウムは、ほとんど全部が析出します。
これをろ過して分け、よくかわかして強く熱すると下の④式のように反応し、二酸化炭素を発生して炭酸ナトリウムになります。
このとき、ろ液の中には塩化アンモニウムや炭酸水素ナトリウム・食塩などがふくまれています。
これをアンモニア発生塔におくり石灰炉からくる石灰乳と反応させると、アンモニアが分離します。
このアンモニアをアンモニア吸収塔におくります。
また①式で、炭酸水素ナトリウムから炭酸ナトリウムをつくるときに発生する二酸化炭素は石灰炉からでる二酸化炭素といっしょにして、ソルベー塔におくります。
このようにアンモニアソーダ法では反応の途中でできた副産物を工程にもどして利用することができるので、非常に経済的です。
そのうえ、できた炭酸ナトリウムは、ほとんど純粋です。
上の図は、アンモニアソーダ法の工程をくわしくしめしたものです。
この図からもわかるように、種類の少ない原料から炭酸ナトリウムのほかにも、炭酸水素ナトリウム・水酸化ナトリウムのソーダ類、塩化アンモニウム・塩化カルシウムの塩類など、たくさんの製品ができます。
そのため、アンモニアソーダ法は化学工業にとって重要な方法です。

