窒素
空気の成分は、酸素と窒素が主ですが瓶の中などでロウソクを燃やすと酸素が使われて、二酸化炭素ができます。
それで瓶の中に残った空気中には窒素のほかに、二酸化炭素もふくまれているわけです。
図のように、底のない瓶の中で黄リンを燃やすと酸素が使われて五酸化リンができます。
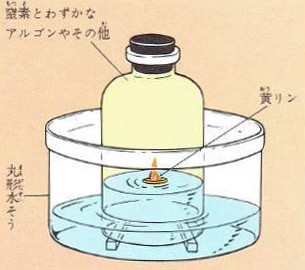
五酸化リンは水に溶けるので酸素の量だけ水が瓶の中にあがりあとに、窒素とアルゴンが残ります。
窒素の製法
窒素は、酸素と同じように液体空気から分けてとりだされます。
これは、液体から気体になる温度が酸素と違うことを利用するのです。
窒素の性質
窒素は、色もにおいもない気体で比重は、空気を1とすると0.967です。
窒素は、酸素と違って物を燃やすはたらきをもっていません。
また、人をはじめ、ほかの動物も窒素だけの中では生きていられません。
しかし、窒素は毒ではありません。
窒素は、アンモニアや硝酸カリウムとなって植物の肥料になっています。
窒素肥料とよばれているのはこれら植物の生長を助ける窒素化合物のことです。
また、食物にふくまれていて私たちになくてはならない栄養素のたんぱく質も、窒素をふくむ化合物です。
窒素の用途
液体窒素は、液体酸素と違って物を燃やす心配がないので温度を低くしなければできない研究などによく使われます。
また、窒素が物を燃やさない性質を利用して、電球につめられます。
しかし、このように窒素がそのままで使われる例は少なくたいてい、アンモニアや硝酸などのように窒素を化合物としてから利用しています。
窒素化合物は、火薬・染料・医薬品などいろいろなものの原料として使われるのです。
アンモニア
窒素と水素を体積で1対3の割合にまぜ大きい圧力をかけ、50℃ぐらいに熱するとアンモニアができます。
このとき、触媒として、鉄に酸化アルミニウムをまぜたものを使います。
また、実験室でアンモニアをつくるには試験管に塩化アンモニウムと水酸化カルシウム(消石灰)を入れて熱します。
アンモニアは、鼻をつくようなにおいのある無色の気体です。
空気より軽く、水によく溶けます。
その水溶液をアンモニア水といい塩基性をしめします。
また、アンモニアは液体になりやすく15℃では7気圧、零下33℃は1気圧でも液体アンモニアになります。
この液体アンモニアが気体になるときは周りから大きな熱量を奪うので氷をつくったり、物を冷やしたり凍らせたりするときに使われます。
アルゴン
アルゴンは、空気中に1パーセントしかない気体です。
燃えもせず、物が燃えるのを助けるはたらきもなくまた、どんなものとも化合しません。
電球などにつめておくとフィラメントが蒸発するのをふせげるのでガス入り電球に利用されています。