同位体
原子核にふくまれる陽子と中性子の数とを足したものを質量数といいます。
今ここに、陽子が1つで中性子の数がそれぞれ、0・1・2のつまり質量数が、1・2・3と違う原子核をもつ3つの原子があるとします。
この3つの原子は、みんな陽子を1つずつもっていますから原子番号が1の水素原子だということになります。
しかし、重さはそれぞれ、1対2対3の割合になっています。
この重さから違う原子は軽いほうから順に軽水素・重水素・三重水素とよばれ
どれも水素の原子です。
このように、原子番号が同じで質量数が違う原子を、同位体(アイソトープ)といいます。
放射性同位体
水素の同位体のうち三重水素は原子核が壊れやすく、放射能をもっています。
たいていの元素には放射能をもった同位体があって特に放射性同位体と呼ばれています。
ストロンチウム90・セシウム137・コバルト60などとよばれている元素はすべて放射性同位体です。
これらの元素の名前の下についている数はそれぞれの元素の質量数をあらわしています。
三重水素・ストロンチウム90などは原水爆実験などでできる人工的な同位体ですが天然にも、ウランやラジウムなどのように放射能をもった元素があります。
放射能に人体に害をあたえますが病気の治療、金属の検査、農作物の研究品種改良などに利用できます。
例えば、放射性同位体からでる放射線を当てて体の内部にできたガンの組織を破壊することができます。
また、肥料の中に放射性同位体を混ぜて農作物のからだに肥料がどのように吸収されるかを調べたり(トレーサー)ジャガイモに放射線をあてて発芽をおさえ長く保存できるようにすることもできます。
放射線には、α栓・β栓・γ線などがありますがもちろんこれらをを目で見ることはできません。
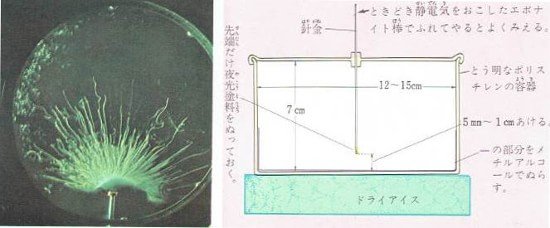
しかし、図のような装置を用いて実験すると夜光塗針にふくまれている放射性物質からでてくる放射線(α線)の通った道(飛跡)を肉限で見ることができます。