塩の加水分解
塩化ナトリウムのように、強酸と強塩基とからできて卜る塩の水溶液はリトマスにたいして中性をしめします。
しかし、塩化アンモニウムのように強酸と弱塩基とからできている塩の水溶液はリトマスにたいして酸性をしめします。
また、酢酸ナトリウムのように弱酸と強塩基とからできている塩の水溶液はリトマスにたいして塩基性をしめします。
たとえば、塩化アンモニウムを純粋な水に溶かした場合を考えてみます。
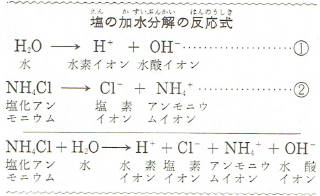
純粋な水は、ごくわずかですが、上の①式のように電離しています。
しかし、水素イオンと水酸イオンの数が同じなので、中性をしめします。
この水に塩化アンモニウムを溶かすとすぐ電離して②式のようにアンモニウムイオンをつくります。
このアンモニウムイオンは、水が電離してできた水酸イオンとむすびついて
アンモニア水をつくります。
あとには、塩素イオンと水素イオンが残ります。
このため、液の中には水酸イオンが少なくなります。
そうすると、水が電離して水素イオンと水酸イオンをだしますがこれがくりかえされると液の中の水素イオンの割合が多くなります。
つまり、液全体を考えるととうぜん液は酸性をしめすことになります。
酢酸ナトリウムが塩基性をしめすことも、同じように説明できます。
塩が水と作用して、塩基性や酸性をしめすようになることを塩の加水分解といいます。
強酸と強塩基との塩は加水分解せず中性をしめし強酸と弱塩基との塩が加水分解すると酸性をしめします。
また、弱酸と強塩基との塩が加水分解すると塩基性をしめし弱酸と弱塩基との塩が加水分解すると多くの場合中性をしめします。