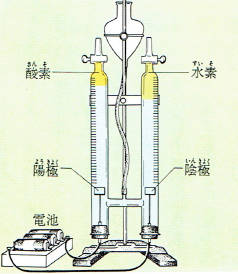
食塩水の電気分解
食塩は塩化ナトリウムという電解質でできていますが
この濃い水溶液を電気分解してみましょう。
実際に実験してみると
陽極から塩素が、陰極から水素が発生することがわかります。
そして、陰極に近い水は水酸化ナトリウムの水溶液となっています。
このときの反応は、つぎのように説明されます。
① 水に溶けた食塩は、ナトリウムイオンと塩素イオンとに電離しています。
② 塩素イオンは陰イオンですから陽極に引かれ電極にくっついて、塩素原子になります。
そして、塩素原子が2個で塩素分子をつくり、水に溶けたり、気体になったりします。
③ ナトリウムイオンは陽イオンですから陰極に引かれますが陰極の材料によって様子が違います。
(A) 陰極が黒鉛や鉄でできていると水のわずかな電離でできた水素イオンが陰極にくっついて水素原子となりこれから水素分子となります。
一方、液の中には、ナトリウムイオンと水酸イオンとが残るわけですから水分を蒸発させると、水酸化ナトリウムが残ります。
(B) 陰極が水銀だと、ナトリウムイオンは一の電気と結びついて、ナトリウム原子となって水銀に溶けます。
この水銀に水を通すと、ナトリウムが反応して水酸化ナトリウムと水素になります。
ここでできた水酸化ナトリウムは強電解質ですから水に溶けている間は、ナトリウムイオンと水酸イオンとに電離していますが液を蒸発させると水酸化ナトリウムの固体としてえられます。
なお、食塩水の電気分解においては陰極にできた水酸化ナトリウムと陽極にできた塩素とが反応して塩素酸ナトリウムNaclO3ができることがあります。
これを防ぐために、食塩の工業的電気分解には陰極と陽極を隔膜で分ける隔膜法や陰極に水銀を用いる水銀法などが用いられるわけです。
食塩水は、工業的に塩化マグネシウム・硫酸マグネシウム・硫酸カルシウムなどの製造原料として大切なものですがいちばん重要な用途は、電気分解することにより塩素・水素・水酸化ナトリウム・ナトリウムなどをつくることです。
このような工業を、ソーダエ業といいます。
水酸化ナトリウムや水素の性質についてはほかのところで詳しく説明してありますからここでは、塩素とナトリウムについて調べてみましょう。