電解質の水溶液に電流を通すとイオンが電気を運ぶ役目をして電極にくっついて電気を失い、もとの物質と違う物質を生じます。
イオンがあれば、いつもこのような電気分解が行われるかどうかこれから調べることにしましょう。
電気分解の原理
電解質の水溶液には陽イオンと陰イオンとが数多くあります。
この溶液に、2つの電極を浸して片方を電池の陽極につなぎ、もう一方を陰極につなぎます。
すると、陽イオンは陰極のほうへ陰イオンは陽極のほうへ引っぱられて動きます。
つまり、水溶液の中を電流が通るわけですが金属の中を電流が通るときと様子が違います。
金属の中では電子が動いて電流が流れることになりますが水溶液の中では、イオンが電気を運ぶので電流が流れます。
物質そのものが移動するのです。
水の電気分解
純粋な水は、ほとんど電離していませんからイオンが少なくて電流が流れません。
しかし、水酸化ナトリウムや硫酸のような電解質を溶かすと電流がよく流れるようになります。
ここでは水酸化ナトリウムを溶かした水溶液を電気分解するときのことを考えてみましょう。
水酸化ナトリウムの水溶液には陽イオンのナトリウムイオンと陰イオンの水酸イオンがたくさんあります。
このうちの水酸イオンは-の電気をもっていますから陽極に引っぱられてくっつき電極の+の電気をもらって、電気を帯びなくなります。
そして、水酸イオンの電気のなくなったものが酸素と水に変化して、陽極からは酸素が発生するわけです。
また、ナトリウムイオンは陰極に引きつけられますがなかなか電極にくっつきません。
かえって、水がごくわずか電離して生じている水素イオンのほうが陰極にくっつき、電極の-の電気をもらって電気を帯びない水素原子になってしまいます。
そして、水素原子が2個集まって水素分子となり、陰極から水素が発生します。
水酸イオンや水素イオンが少なくなると、水が新しく電離してこれを補うので結局は、水の電気分解となり、水酸化ナトリウムは変化しないことになります。
実験室で、電気分解をする場合はホフマン電解装置という図のような装置がよく用いられます。
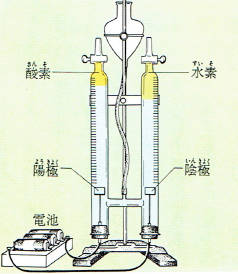
電極のところをよく観察すると陽極から酸素が、陰極から水素が発生しているのがわかります。
水の電気分解をまとめると式にあるように、水2分子から水素2分子と酸素1分子ができる反応ですから電気分解によって生じる酸素と水素の体積は常に1対2となります。