水酸化ナトリウムの工業的製法
水酸化ナトリウムは、工業的には、食塩(塩化ナトリウム)を原料としてつくります。
その方法には、食塩水を電気分解し直接水酸化ナトリウムにかえる電解法と食塩から炭酸ナトリウムをつくってそれを水酸化ナトリムにかえるアンモニアソーダ法とがあります。
電解法は、さらに隔膜法と水銀法とに分けられます。
隔膜法
隔膜法は図のような電界そうを使っておこないます。
濃い食塩水を上から流しこむと、食塩水は電気分解を受けながら底に張った石綿の隔膜を通り抜けて下に落ちます。
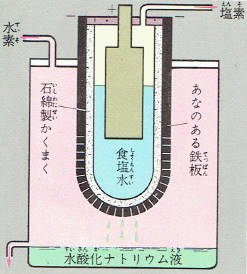
黒鉛の陽極からは、塩素ガスが発生し隔膜の下にはった穴のある鉄板の陰極からは水素ガスが発生します。
鉄板の穴を通り抜けた食塩水は、水酸化ナトリウムをふくむようになります。
この液をに詰めると、食塩が結晶になってでてきますからそれをろ過して取り除き、残りの液を冷やすと水酸化ナトリウムの固まりができます。
水銀法
水銀法では、下の図のように、電解槽に隔膜はなく底に水銀がうすく流れていて、これが陰極になっています。
そのほかは、隔膜法とよく似ていて黒鉛の陽極からは塩素が発生します。
いっぽう、水銀の陰極ではナトリウムイオンが放電してナトリウム原子となり、水銀に溶け込みます。
これをナトリウムアマルガムといいます。
ナトリウムアマルガムは、横から流れだし別の水槽(解こう塔)に導かれそこで、ナトリウムと水が反応して水素を発生し水酸化ナトリウムができます。
ナトリウムをはなした水銀は、また電解槽に導かれて使われ解こう塔にできた水酸化ナトリウムをふくんだ水は取り出して煮詰められ、水酸化ナトリウムがつくられます。
隔膜法でつくられた水酸化ナトリウムは、食塩がまざって不純になりますが
水銀法でつくられたものは非常に純粋な水酸化ナトリウムです。
また、隔膜法でも水銀法でも水素と塩素が気体としてえられますがこれからは、塩酸がつくられます。
水酸化ナトリウムの実験室的製法
実験室では、アンモニアソーダ法と同じように炭酸ナトリウムから水酸化ナトリウムをつくります。
炭酸ナトリウム・水酸化カルシウム・水をまぜると炭酸カルシウムの白い沈殿ができます。
この沈殿を取り除いて液を煮詰めると、水酸化ナトリウムができます。
この方法でも、水銀法と同じように純粋な水酸化ナトリウムをつくることができます。
複分解
炭酸ナトリウムに水酸化カルシウムが作用するときの反応式をよく見るとナトリウムとカルシウムとが入れかわっていることがわかります。
このような反応を、複分解といいます。