水酸化ナトリウムの性質
水酸化ナトリウムは、白色のもろい固体で比重2.13、融点は318.4℃です。
水に非常によく溶けて、そのとき熱をだします。
水溶液は強い塩基性をしめしますがこれは、水に溶けた水酸化ナトリウムが水の中ではナトリウムイオンと水酸イオンとに、ほぼ完全に電離しているからです。
また水酸化ナトリウムは空気中の水分を吸ってべとべとになる性質があります(潮解性)。
さらに、空気中の二酸化炭素をよく吸い炭酸ナトリウムになる性質があります。
それで、固体の水酸化ナトリウムをつめた瓶に空気などの気体を通すとその気体にふくまれる水分や二酸化炭素を取り除くことができます。
水酸化ナトリウムの水溶液は、酸と中和反応をおこすほかアルミニウムや亜鉛などの金属を溶かして、水素を発生します。
このときの溶け方は、酸の場合とは少し違っています。
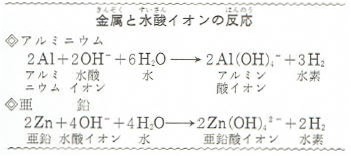
アルミニウムや亜鉛は、そのままイオンになってとけるのではなく上の式のようにそれぞれアルミン酸イオンや亜鉛酸イオンなどになって溶けるのです。
また水酸化ナトリウムは、たんぱく質を溶かします。
そのため、毛や毛糸につくとこれを傷めます。
また、皮膚につくとぬるぬるとした感じがするのも、このためです。
水酸化ナトリウムが毛や毛糸・皮ふなどについたときには酢酸など弱酸のうすい水溶液で洗うとよいでしょう。
油に水酸化ナトリウムを作用させるとふつうでは水に溶けない油が、水に溶けるようになります。
これは、水酸化ナトリウムの作用で油がセッケンにかわったためです。
このように、水酸化ナトリウムと油脂とからセッケンができる作用をケン化作用といいます。
水酸化ナトリウムの用途
水酸化ナトリウムは、非常に重要な工業薬品で水酸化ナトリウムを使わない化学工業はないといってもよいほどです。
レーヨン(人造絹糸)の製造に多量に使われるほか製紙・アルミニウムの製造、染料・セッケンの製造および石油精製に使われています。