水素と酸素の化合
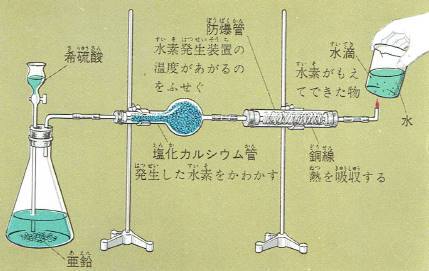
水を分解すると、水素と酸素が体積で2対1の割合でできますがこれとは逆に、水素と酸素とから水をつくることもできます。
しかし、水素と酸素とを体積で2対1の割合に混ぜただけでは水はできません。
この気体に火をつけると、爆発して水素も酸素もなくなり、水ができるのです。
この実験は、大量の気体で、壊れやすい器具を使って行うと危険です。
図のような装置を使い、少量の気体で水の中で行うと安全にできます。
この装置で、ニクロム線に電気を通し気体に火をつけると、爆発がおきます。
そして、管の中を水が上がるので気体がなくなったことがわかります。
もし、水素と酸素の割合が2対1になっていないと多いほうの気体のうち、余分なものが水にかわらずそのまま管の中に残ります。
水のかわりに、水銀を入れたユージオメーターという装置を使うと水素と酸素から水ができることが観察できます。
このように、水素と酸素がはたらきあって、結びつき水になることを、水素と酸素が化合して、水ができたといいます。
化合と合成
一般に、2つ以上の物がはたらきあって結びつきもとの物とは違った、全く新しい物になることを、化合といいます。
また、化合によってできる物を化合物といいます。
化合物をつくるもとの物の割合は水が水素2体積と酸素1体積の割合でできるように化合物によって決まっています。
気体以外の物では、体積では比べられれないので重さの割合で比べますがやはりもとの物の重さの割合は決まっています。
水素と酸素を化合させて水をつくったように化合を利用して化合物をつくることを合成といいます。
私たちの身の周りには、合成によってつくられたものが実にたくさんあります。
合成樹脂・合成ゴムはもちろんのこと塩酸やアンモニアなどの薬品のほとんどが合成によってつくられています。
化学変化と物理変化
分解や化合でできた物は、もとの物とは全く違った新しい物です。
このような分解や化合によっておこる変化を化学変化といいます。
水が分解して、水素と酸素とになる変化は化学変化です。
これに対して、水が熱せられて水蒸気になったり冷やされて氷になったりする変化は水の状態が変化するだけであって水そのものが変化したわけではありません。
このように、状態だけが変化することを物理変化といいます。
食塩を水に溶かすと、食塩と同じように塩辛い水になりますが食塩水を蒸留すると、また食塩と水がえられます。
この物が溶けるということも物理変化です。