再結晶法
硝酸カリウムやホウ酸などは温度によって溶解度の変化が著しい物質です。
これらの物質は、高温において飽和溶液をつくり、この溶液を冷やすと溶解度が減少するために、溶質が純粋な結晶として析出してきます。
このように、いちど溶解して冷やし結晶させる方法を再結晶法といいます。
再結晶すると、純粋に近い結晶を取り出すことができます。
例えば、80℃の水100グラムに5グラムのホウ酸を溶かした水溶液を20℃に冷やしたときについて考えてみましょう。
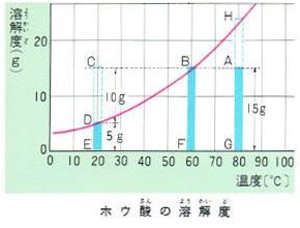
80℃の水100グラムに15グラムのホウ酸を溶かした水溶液は図のAGでしめされます。
これは、溶解度HGには達していません。
この水溶液の温度を下げて、60℃にすると飽和溶液ができます。
さらに水溶液の温度を下げて20℃にすると20℃におけるホウ酸の溶解度はDEですから今まで水溶液中に溶けていたホウ酸15グラムのうち10グラムは溶けきれなくて結晶となって析出するのです。
また、飽和溶液を熱して水を蒸発させると結晶が析出します。
これは、水の量が少なくなるので溶質の溶ける量が少なくなるからです。
食塩などのように溶解度が温度によってそれほどには変化しない物質は再結晶法より溶液を熱して水を少なくすることによって結晶を取り出す方法がよく用いられます。
再結晶によって、なぜ純粋な物質が得られるのでしょう。
不純物を含んだ硫酸銅の結晶を水に溶かすと硫酸銅も混合している不純物も水に溶解します。
(このとき、不純物が水に溶けないものであればその不純物はろ過によって取り除くことができます)
一般に、不純物の量は硫酸銅の結晶に比べて少量ですから高い温度にして硫酸銅の飽和溶液をつくっても不純物については薄い溶液なのです。
したがって、この水溶液を冷やしても析出する結晶は硫酸銅ばかりで不純物は溶液に溶けたまま残るのです。
実際には、結晶ができるとき溶液が包みこまれたり、結晶の表面に付着したりするので不純物の全てを取り除くことは難しく2回、3回と再結晶を繰り返すことによってより純粋なものになります。
溶液に他の液体を加えて結晶をつくる方法
水には溶けるが、アルコールには溶けない物質があります。
この物質を水に溶かした溶液にアルコールを加えると物質を溶かしていた水はアルコールに溶け込むので溶質の溶解度加減少し、溶質が結晶となって析出します。
例えば、硫酸第一鉄の濃い水溶液にアルコールを少しずつ加えていくと硫酸第一鉄が析出するので、この方法は硫酸第一鉄の製法に用いられれます。