酸と塩基が中和反応によって塩をつくることがわかりました。
また、塩は中和反応以外の方法でもできることがわかりました。
ここでは塩にはどのような種類があるかまた、おもな塩にはどのような性質があるかを調べましょう。
塩は、そのでき方によって、いくつかの種類に分けられます。
正塩
一塩基酸と一酸塩基とからは、ただ1つの塩しかできません。
たとえば、塩酸と水酸化ナトリウムからは下の①式のように、塩化ナトリウムだけしかできません。
多塩基酸や多酸塩基の場合は、いろいろな塩ができますが多塩基酸の水素全部が陽イオンでおきかわると下の②式のような塩ができます。
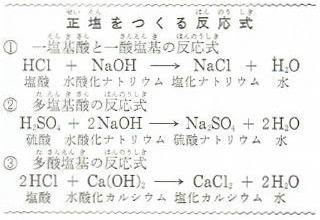
また、多酸塩基の水酸イオン全部が陰イオンでおきかわると③式のような塩ができます。
このようにしてできた塩化ナトリウム・硫酸ナトリウム・塩化カルシウムなどの塩は分子の中に水素や水酸基をふくんでいない塩です。
このような塩を正塩といいます。
正塩は、酸性塩や塩基性塩にたいして中性塩とよばれることもありますがリトマスにたいして必ず中性をしめすとはかぎりません。
それは、塩をつくる酸や塩基の強弱によって加水分解をおこすことがあるからです。
酸性塩
多塩基酸の水素の一部分が、陽イオンでおきかえられていてまだ陽イオンでおきかえることのできる水素がの素塩といいます。
たとえば、硫酸と水酸化ナトリウムの中和のとき水酸化ナトリウムを少量くわえた状態では下の①式のような硫酸の第一段の電離でできる水素イオンだけが中和されて②式のように、硫酸水素ナトリウムのような酸性塩ができます。
酸性塩の水溶液は、酸性をしめすとはかぎりません。
たとえば、炭酸水素ナトリウムの水溶液は塩基性をしめします。
塩基性塩
多酸塩基を中和するとき、多酸塩基の水酸基の一部分だけが陰イオンでおきかえられていてまだ、陰イオンでおきかえることのできる水酸基が残っているような塩ができることがあります。
このような塩を、塩基性塩といいます。
塩基性塩の水溶液も、必ず塩基性をしめすとはかぎりません。