脂肪の成分
脂肪を過熱水蒸気などで分解すると、グリセリンと脂肪酸とに分かれます。
これは脂肪が加水分解をしたのです。
この分解によってできた脂肪酸は、一種の酸なので水酸化ナトリウムをくわえると中和され、塩をつくります。
このような脂肪の分解を、ケン化といいます。
脂肪の加水分解を反応式であらわすと、下のようになります。
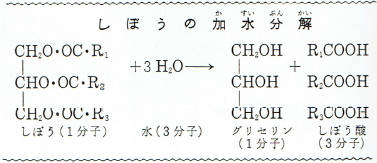
この式のなかで、Rというのは、アルキル基のことでR2、R3は炭素の数の違う
いろいろのアルキル基をあらわしています。(アルキル基というのはCnH2n+1という式であらわされる炭化水素の原子団でメチル基CH3―、エチル基C2H5―などがあります。
さて、動植物体に貯蔵されている脂肪の大部分はグリセリン一分子と、脂肪酸三分子とから三分子の水が分離された形の結合をしてできているのです。
これを中性脂肪ともいいます。
このグリセリンに結合している3つの脂肪酸は全部同じのものもありますが大部分の脂肪では、違った2種か3種の脂肪酸がむすびついています。
グリセリン
グリセリンは、脂肪をケン化してできたものでグリセロールともリスリンともいわれ、水やアルコールによく溶ける液体です。
甘味があり、その強さは、砂糖の6分の1ぐらいといわれています。
私たもの体の中では、グリセリンを酸化して、二酸化炭素と水にしたりぶどう糖をつくったりすることができるのでグリセリンはエネルギー源として、栄養となっていることがわかります。
グリセリンは、化粧品や医薬品の製造に利用されたりニトログリセリンをつくって、ダイナマイトの製造に使われたりしています。
脂肪酸
動植物体内では、脂肪酸がそのままの形であることはほとんどなく、グリセリンと結合して脂肪となっていたりコレステリンやアルコール類と、むすびついています。
ミツバチの巣の主成分である蜜ロウは脂肪酸と高級アルコールとが結合したものです。
脂肪酸は、炭素の原子からなる1本のくさりに水素原子がむすびついていていっぽうのはしに、カルボキシル基―COOHという酸性の原因になる原子団がついています。
天然の脂肪酸は、炭素の数が偶数のものですが炭素の数などによって、いろいろな種類の脂肪酸に分けられます。
低級脂肪酸と高級脂肪酸
酢酸CH3COOHのように、炭素の数の少ないものを、低級脂肪酸といいます。
ラク酸C3H7COOHなども、この仲間です。
また、炭素の数の多いものを、高級脂肪酸といいます。
酢酸は、水に溶けて酸性をしめしますが、炭素数の多い脂肪酸も、含水アルコールに溶けてリトマス紙を赤にかえたり塩基を中和させたりする酸の性質をもっています。
飽和脂肪酸と不飽和脂肪酸
脂肪酸には、炭素のくさりに水素が充分についているためヨウ素と結合しにくい性質をもったものと炭素のくさりにつく水素原子の数が不十分なため、ヨウ素と結合しやすい性質のものとがあります。
ヨウ素と結合しにくい脂肪酸を飽和脂肪酸といいます。
ステアリン酸・パルミチン酸などはほとんどすべての脂肪にふくまれている飽和脂肪酸です。
これにたいして、ヨウ素と結合しやすい脂肪酸を不飽和脂肪酸といいます。
オレイン酸・リノール酸・リノレン酸などがあります。
オレイン酸は、ほとんどすべての脂肪にふくまれています。
また、リノール酸、リノレン酸はすべての乾性油・半乾性油にふくまれているものです。