二酸化炭素の製法
二酸化炭素は炭素や炭素の化合物を燃やす以外の方法でもつくれます。
石灰石に希塩酸をかける
石灰石のかけらをビー力に入れ希塩酸を注ぐと、二酸化炭素が泡になって発生します。
石灰石の主な成分は、炭酸カルシウムでこれが塩酸と反心して、二駿化炭素ができるのです。
ですから、石灰石のかわりに、炭酸カルシウムを主成分とす貝殻を使っても二酸化炭素ができます。
炭酸水素ナトリウムに塩酸をかける
炭酸水素ナトリウムは、重曹といわれているものです。
ここに塩酸を注ぐと、二酸化炭素が発生します。
炭酸ナトリウムに塩酸をかける
炭酸ナトリウムは、ソーダ灰とよばれる白色の粉です。
これに塩酸をかけると、二酸化炭素ができます。
塩酸のかわりに酢(酢酸がふくまれている)を使ってもできます。
二酸化炭素の性質
二酸化炭素は、においも色もなく空気の約1.5倍も重い気体です。
この気体は燃えもせずまた、物が燃えるのを助けるはたらきもありません。
これは、水槽に高さの違うロウソクを入れて火をともし、二酸化炭素を入れると下から順に火が消えていくことでもわかります。
また、二酸化炭素は、圧力をかけると容易く液体になります。
ところが、ふつうの圧力のまま、零下78.5℃まで冷やすと液体にならずに白い固体になってしまいます。
これがドライアイスです。
このドライアイスを空中においておくとすぐに気体の二酸化炭素にもどります。
このように、気体からすぐに固体になったり固体から気体になったりすることを昇華といいます。
二酸化炭素が炭素と酸素との化合物であることは二酸化炭素の中に燃えているマグネシウムを入れてみるとわかります。
このとき、マグネシウムは、二酸化炭素の中でも燃え続け黒い粉ができますが同時に白い煙を出します。
この白い煙は酸化マグネシウムですが黒い粉は炭素がまじっているのです。
マグネシウムは、酸素とむすびつく力が非常に強く二酸化炭素をつくっている酸素と化合して酸化マグネシウムとなり炭素がススとして残るのです。
二酸化炭素の水溶液
二酸化炭素は、水に割りあいよく溶けます。
二酸化炭素を水に溶かしてみるには下の図のような装置で、二酸化炭素を丸底フラスコに集め蒸留水を20立方センチほど入れて管のついた栓をします。
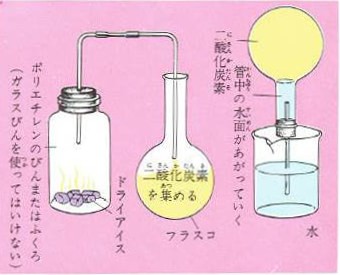
これを逆さまにして水の上に立てフラスコを振ると、フラスコの中の二酸化炭素が水に溶けるので、水が上がってきます。
ところが。フラスコに、水のかわりに水酸化ナトリウムの水溶液を入れておくとフラスコに上がってくる水の勢いがかなり強くなります。
これは、二酸化炭素が酸のはたらきをし水酸化ナトリウムと化合して炭酸ナトリウムができ急に体積が減るからです。
二酸化炭素は、このように酸のはたらきをするため、炭酸ガスともよばれます。
二酸化炭素の水溶液は、弱い酸性をしめします。
しかし、これを調べる場合つぎのページの図にあるように炭酸ナトリウムに塩酸をまぜて直に水に溶かした水溶液を使うのはよくありません。
それは、この場合、できた水溶液に塩酸のしぶきが飛び込んでその塩酸のために酸性になっていることがあるからです。
塩酸のあることは、硝酸銀を加えてみると白くにごることからわかります。
塩酸のしぶきが飛び込まないようにするには水を染み込ませた綿を管につめ、この中に二酸化炭素を通せばよいのです。
二酸化炭素の利用
二酸化炭素を多量に水に溶かしたものは口に入れるとさわやかな感じがします。
それで、これに甘味や酸味をつけてラムネやサイダーのような清涼飲料水をつくるのに使われます。
また、二酸化炭素を凍らせたドライアイスは冷たい物を保存するのに利用されます。
そのほか、空気より重いこと火を消すはたらきがあることなどを利用して消火器に応用されています。