結晶の形
結晶は、いくつかの平面とその平面が交わるいくつかの辺とで囲まれた立体です。
結晶には大きなものも、小さなものもあります。
また、板状のものや、針状のものなど、その形はさまざまです。
しかし、結晶の形は物質によって必ず決まっています。
結晶が小さくて、粉のように見えるものでも虫眼鏡や顕微鏡で見ると大きい結晶と同じ形であることがわかります。
例えば、塩化ナトリウムの結晶は必ず立方体の形をしています。
また、雪の1粒を虫眼鏡や顕微鏡で見ると六角形の美しい結晶であることがわかります。
氷は水の結晶がたくさん集まったものですがその1つ1つの結晶の形は雪とまったく同じものです。
雲母の結晶も六角形ですが薄くはげる性質があります。
また、水晶(石英の結晶)は結晶として代表的なものです。
これらのはっきりした結晶に比べて寒い日にガラスに凍りついた霜やトタンの表面の亜鉛の模様などは、ちょっと結晶ではないように見えますがこれらも小さい結晶の集まりなのです。
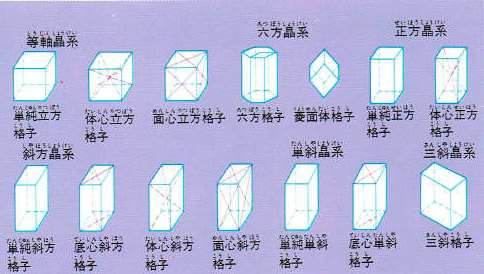
結晶の形は、このように多いのですが、そのもとになる形はあんがい少なくだいたい図にしめした14種類の形に分けることができます。
再結晶
結晶になっている物質をいちど溶液にしてその溶液からまたもとの物質を結晶として取り出すことを再結晶といいます。
再結晶をすると、結晶に混じっているごみや不純物を取り除くことができ非常に純粋な物質ができます。
実験
ごみや不純物の混じっている硫酸銅を再結晶させるには、つぎのようにします。
まず、不純物などの混じった硫酸銅の結晶を湯に溶かして、飽和溶液をつくり
これを、保温ろうとを使ってろ過します。
このとき、水に溶けないごみなどの不純物は取り除かれます。
ろ液を冷たい水の中につけ、かきまぜながら冷やして小さい結晶を析出させます。
結品が析出してきたら、これをろ過して分けとり大きいろ紙に挟んでかわかします。
このときに、水に溶けやすい不純物はろ液といっしょに取り除かれれます。
こうしてできた硫酸銅の結晶は非常に純粋なものです。
再結晶をするには、飽和溶液を冷やす方法のほか溶媒だけを蒸発させる方法や溶媒の種類をかえる方法などがあります。