水が温まる様子を見ていると水を入れた器の底に泡がつきます。
この泡は、水に溶けていた空気が気体になったものです。
ここでは、気体が水に溶ける様子を調べてみましょう。
気体の圧力と溶解度
アンモニアや塩化水素などの気体は非常に水に溶けやすく、その水溶液はそれぞれ、アンモニア水・塩酸とよばれています。
これにたいして、酸素や水素などの気体はあまり水に溶けません。
また、溶質が固体や液体のときは圧力がかわっても溶解度はそれほどかわりませんが溶質が気体のときは、圧力がかわるにつれて溶解度が非常にかわります。
例えば、サイダーやビールの瓶の中は二酸化炭素の圧力が高く多量の二酸化炭素が溶解しています。
ところが瓶の栓をとると、急に圧力が下がるために二酸化炭素の溶解度も下がりそれまでサイダーやビールに溶けていた二酸化炭素の一部が、泡になって逃げ出します。
サイダーやビールの瓶を空けると泡が吹きこぼれるのも二酸化炭素の溶解度が小さくなったために起こることです。
このように、圧力をかけて気体を水に溶かすと圧力をかけないときより多く気体が溶けます。
詳しく調べると、温度を同じにしておけば100グラムの水に、1気圧で2グラム溶ける気体は2気圧では4グラム溶けることがわかります。
つまり「温度が一定ならば、気体の溶解度はその圧力に比例する」ということになります。
これをヘンリーの法則といいます。
ところが、ボイルの法則によると気体の体積は、温度が一定ならば圧力に反比例します。
したがって、圧力が2倍になると気体の体積は2分の1になります。
ですから、ヘンリーの法則は「温度が一定ならば、決まった体積の水に溶ける気体の体積は圧力がかわっても変化しない」といいかえることもできます。
温度と気体の溶解度
水を温めていくと、沸騰する前に空気が泡になって浮かび上がってきます。
これは、水が温められて空気の溶解度が減ったために起こることです。
一般に、気体の溶解度は固体の場合と違って温度が上がるとかえって減ります。
このこととは、サイダーで試すとよくわかります。
まずサイダー瓶の栓を抜くと圧力が下がるので二酸化炭素が泡になって、盛んに出てきます。
これをビーカーに注ぐとしばらくの間、泡がでますがそのままほうっておくと、しまいに泡がでなくなります。
こうなったサイダーを温めるとまた、盛んに泡がでるようになります。
下の表は、酸素や水素などの気体が1気圧のときにいろいろな温度の水1キログラムに、どれだけ溶けるかをしめしたものです。
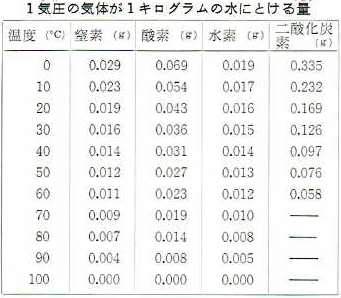
この表で、窒素や酸素などの気体は水1キログラムに、0.1グラムも溶けないことがわかります。
つまり、空気は水にあまり溶けないわけです。
0度の水に溶ける酸素0.069グラムは体積になおすと86立方センチたらずですが
この酸素は、魚や貝など水中で生活する動物にとってはなくてはならないものです。
この表にあげた気体と違ってアンモニアや塩化水素などの気体は非常によく水に溶けます。
例えば、1気圧・0℃のときには1キログラムの水に、アンモニアは882.5グラム、塩化水素は、821.3グラムも溶けます。