石油の分留
炭化水素はいっぱんに、分子の大きさが増すにつれて、沸点がだんだん高くなります。
そのため常温(ふつうの温度)で気体のもの、液体のもの、固体のものなどがあり
それらが溶けあって原油を形づくっています。
それで原油に熱をくわえると、分子の小さいものから順々に気体(蒸気)になって
飛び出してくるので、その蒸気を冷やして分けとると、いろいろな石油製品がえられます。
このように、石油の成分をいったん蒸気にして分ける作業を、石油の分留といいます。
おもな石油製品の沸点(留出温度)の広がりかたは表のようになります。
沸点が少しずつ重なりあっていますが、燃料として使う場合このことは差支えありません。
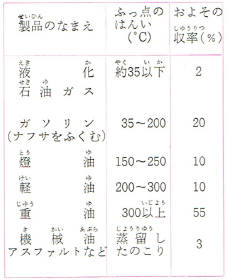
また、表のなかに原油からとれる割合(収率)がしめされていますが
これも原油の産地、種類などによって、非常に違うので、決まった数値ではありません。
ガソリン分のうち、沸点の高い部分が石油化学工業の原料として使われ
その量は自動車用ガソリンと同じくらいか、またはそれ以上にもなります。
これをナフサとよんでいます。
機械油は、重油分を真空に近い圧力のもとで、細かく分留してつくります。
その一部から、さらにパラフィンロウ・ワセリンなどもつくりだされます。
アスファルトには、原油を分留したあとに残っていて
そのまま使えるスレートアスファルトと、重油分に熱した空気をふきこんで
重合させてつくるブローンアスファルトの2種類があります。
石油製品の精製
原油を分留してつくられたいろいろな石油製品は、そのままでも使われますが
たいていの場合、品質をよくするためにさらに精製したり加工したりします。
とくに、ガソリンと機械油にはこれが必要です。
原油には、硫黄・酸素・窒素などの化合物がふくまれているため
これらがどうしても、石油製品の中に入ってきます。
そしてこれらの化合物は、ごくわずかでも
製品のにおいや色を悪くしたり金属をさびさせたりします。
ガソリンや灯油の場合には、硫酸・塩基の溶液、水などで洗えば
それらの不純物(まじりもの)の大部分を取り除くことはできますが
完全に取り除くためには、触媒を使い高温高圧の水素をはたらかせて処理します。
軽油や重油は、これまで特別な精製をしなくてすみましたが
硫黄化合物が燃えたときに発生する二酸化硫黄が大気を汚すおもな原因になりますので
ガソリンの場合と同じような、水素を使う精製法で軽油や重油も精製されはじめました。
機械油の場合には性質(ねばりけなど)を悪くする成分を分けてとる作業が必要です。
ロウ分とアスファルト分を、冷やして結晶させたり
まじりあわない溶剤(アスファルトなどを溶かしこむ薬品)で
洗って取り除いていく方法で、精製します。
同じ種類の製品について、たとえば重油や機械油の場合は
品質が少しずつ違うものをまぜあわせて、一定の品質のものにする作業も大切です。
これらの精製法のほか、石油製品の品質をよくするため
ごく少しくわえて使う薬品類がいろいろあります。
これらを添加剤とよびます。
添加剤には、ガソリンの燃えかたを調節するもの、機械油のねばりけをよくするもの
アスファルトがもろくなるのを防ぐものなどがあります。
クラッキング
これまでに述べたように、ガソリンはふつう、原油の分留によってつくられます。
しかし自動車・飛行機などが増えるにつれて
分留でつくったガソリンだけでは間に合わなくなってきました。
そこで同じ量の原油から、できるかぎり多くのガソリンをつくりだすことが
研究された結果、軽油や重油を熱によって分解すればガソリンがとれることがわかり。
工業的に行われるようになりました。
この方法をクラッキング(熱分解)、または分解蒸留とよびます。
グラッキングははじめのうち、熱の作用だけでおこなっていましたが
圧力をかけたり、触媒を使うといっそう品質のすぐれたガソリンがとれることが
わかったので、いまは天然または人工の白土を触媒として使う
接触分解法(または、キャットクラッキング)が多く採用されています。
リホーミング
原油から分留法によってえられたガソリンの品質をよくする方法に
リホーミング(または改質)という方法があります。
これはガソリンの中にふくまれている、いろいろな炭化水素のうち
ガソリンの成分としてあまり適当でないような
炭化水素の分子の成り立ち方(分子の構造)を高温高圧の水素ガスの中で
触媒を使ってかえる方法です。
たとえば、炭素原子8個の炭化水素の場合
炭素原子の互いのむすびつき方や水素原子の炭素原子への
むすびつき方にしたがって、たくさんの種類があります。
それらのうちから4種類だけとりだしてしめすと、図のようになります。
この4種類のうち、どれがガソリンの成分としてすぐれているかを比べると
①のような枝分かれのないものよりも、②のように枝分かれしているものがよく
また③と④とでは、水素原子が少ない④のほうがすぐれていることになります。
そこで、①や③のような成分の多いガソリンを、高温高圧の水素とまぜ
白金や酸化クロムのような触媒の上をとおして
②や④のような成分を増加させるのが、リホーミング法です。
このほかにも、ガソリンの品質をよくするような成分をつくる方法がありますが
分留・クラッキング・リホーミングの3つの作業が
製油所でガソリンをつくる場合の、もっとも大切な作業です。