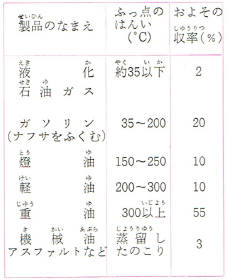
液化石油ガス
原油の分留やグラフやクラッキングをするときに副産物としてでてくる炭化水素ガスのうち、圧力(10気圧ぐらい)をかけるとたやすく液体になる部分を、液化石油ガス(LPG)とよびます。
液化石油ガスには、おもにプロパンとプロピレンがまじったものとおもにブタンとブチレンがまじったものとがあります。
前のほうはおもに家庭燃料や自動車燃料として使われふつう「プロパンガス」とよばれております。
あとのほうは、おもに工場の燃料として使われます。
日本では、木炭・薪・石炭などにかわって家庭で使われたり自動車用ガソリンのかわりに使われる液化石油ガスの量が1960年頃から急に増え国内で製造される分だけでは間に合わなくなりました。
それで、中東地方やインドネシアなとから冷凍タンカーで液化して運ぶことが盛んになりました。
ガソリン
ガソリンは沸点がおよそ35~200℃、炭素原子数が5ないし11ぐらいのいろいろな炭化水素の混合物で、使いみちによって工業用・自動車用・航空成用の3種類に分けられます。
石油化学工業でたくさん使われるナフサは沸点がやや高いガソリンと考えればよいのですが日本ではガソリンと区別してよんでいます。
工業用ガソリンは、原油から分留したままのガソリンで、沸点がやや低いものです。
染み抜きベンジン、ライター油、クリーニング用、塗料のシンナー、ダイス油製造用などに使われます。
自動車用ガソリンは、おもに自動車燃料として使われるもので分留・クラッキング・リホーミングなどいろいろな方法で製造したものをまぜあわせ品質を整え、それに四エチル鉛という薬品をくわえてつくります。
四エチル鉛は、ガソリンのオクタン価を高くすつのにたいへん役に立ちます。
オクタン価
エンジンはガソリンが蒸気になってエンジンに入り空気とまじりあって激しく燃え、その勢いで力がでるようになっています。
このとき充分にエンジンの力を出させることができるかどうかの尺度として使われるのが、オクタン価です。
オクタン価は、イソオクタンを100、また正ヘプタンを0とし両方の混合物と比較試験(比べるテスト)をして決めます。
エンジンの性能が高くなるほど、ますます高いオクタン価のガソリンが必要となります。
オクタン価の高いガソリンをつくるにはクラッキングやリホーミングを利用するだけではなく四エチル鉛という薬品をごくわずかくわえます。
四エチル鉛は、ものすごい毒作用があるのでこれをくわえたガソリンは染料で色づけすることに決められています。
日本の自動車用ガソリンのオクタン価は、ふつう品(レギュラー)で92ぐらい
特製品で(プレミアム)100ぐらいです。
航空機用(または航空)ガソリンは自動車用ガソリンの品質をいっそう高めたものと考えてよく、とくにオクタン価を高くしてあります。
ガソリンは、プロパンガスと同じように引火して爆発するので、注意して取扱かわなければなりません。
灯油
灯油はガソリンより沸点が高く、分子量の大きい炭化水素の混合物です。
電燈がなかった時代には灯油は灯火用としても大切な石油製品でした。
しかしいまは、灯火用としては灯台や山奥などで少し使われるだけでかえって家庭の石油コンロ・石油ストーブなどに多く使われるようになりました。
また、石油エンジンの燃料、機械を洗う油、塗料溶剤、殺虫剤原料などとしても使われています。
ジェット機の燃料としては、沸点がやや高いガソリンと灯油とが使われますがプロペラ機が減ってジェット機が増えたためまたジェット機がますます大型になるためにこの方面に使われる灯油の量もますます増えています。
軽油
軽油は、灯油よりもさらに沸点が高く、分子の大きい炭化水素の混合物で分留されたものがそのまま使われます。
使い道はディーゼルエンジンの燃料、ストーブ燃料、機械を洗う油、金属を切ったり削ったりするときの工作用の油などです。
重油
軽油よりもいつそう沸点の高い、重い油で、かっ色や黒色の色がついています。
重油は大型船・発電所・工場ボイラー・製鉄工場などの燃料として使われます。
これまで長い間、石炭を使っていたところでも、重油のほうが使いやすく安くつくのでだんだん重油を多く使うようになりました。
日本で1年間に使う石油の量は、約1億2千万キロリットル(1967年度)にもなりましたが、そのうち60パーセントぐらいが重油です。
機械油
機械油は、よく精製されたねばりけのある重い油で機械のすれあう部分にぬるのに使います。
機械油をぬると、すべりやすくなるために摩擦が少なくなり。
機械がすり減るのを防ぎます。
機械にはいろいろな種類があるので機械油も、ねばりけやそのほかの性質を加えた。
いろいろな種類がつくられています。
機械油はまた、金属工作、焼き入れ、さびどめ、電気の絶縁などに使われさらに精製したものは化粧品・グリースなどの原料になります。
アスファルト
アスファルトは、なかば固体の、分子の大きい炭化水素の混合物でねばりけや弾力性があり、低温でもろくならない性質をもっています。
道路舗装材として大切であるほか、堤防工事・コンクリートエ事などのときの防水材、屋根ふきの材料、電気絶縁材料などとして使われます。
パラフィンロウ
沸点が高く、分子量の大きい正パラフィン炭化水素は白色の結晶になります。
これがパラフィンロウです。
木ロウや鯨ロウも同じようにロウとよばれますがこれらは酸素をふくむ化合物ですから、パラフィソロウとは別なものです。
パラフィンロウは、ろうそく・パラフィン紙・クレヨン・マッチの軸木などをつくるのに使われ、また電気絶縁材料、つやだし材料、火薬の湿気をふせぐ材料などとして用いられれます。
ワセリン
成分はパラフィンロウによく似たものですが、結晶にはなりません。
化粧品や薬品をつくるのに使われ、また金属のさびどめ用にも使われます。
グリース
グリースは。機械油にセッケンと少量の水をまぜ、ねりあわせてつくります。
使い道は、機械油と同じです。
石油コークス
重油のクラッキングを長い時間続けるとガス・ガソリン・灯油・軽油などが取れたあとに、炭素分の多いコークスが残ります。
これが石油コークスで、石炭からとれるコークスとくらべて灰分が少ないので、よい電極材料になります。