蒸留による分離
食塩水のように、液体の中に固体が溶けて混合物をつくっているような場合には、この液体を蒸発させて蒸気にし冷やして再び凝縮させると、純粋な液体が得られます。
このような方法で、純粋な液体を分離する操作を、蒸留といいます。
蒸留は普通、下の図のようにして行います。
えだつきフラスコに約2分の1ぐらいの水(固体などを溶かした水)と2~3個の素焼きのかけら(これを沸騰石といいます)を入れ図のように組み立てて熱します。
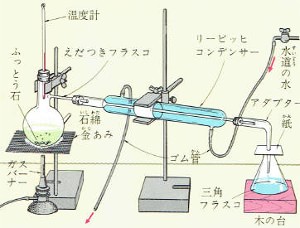
水蒸気は、リービッヒコンデンサーで冷やされて蒸留水となり三角フラスコに溜まります。
このとき、水に気体が溶け込んでいるような場合は100℃になる前に気体は逃げ出してしまいます。
また、アルコールなど、揮発性の液体が混合しているような場合は次に説明する分留という方法で分離することができます。
アルコールに固体が溶解しているような場合にもこれを蒸留すると、純粋なアルコールが得られます。
アルコールが、少量の水を溶かしているような場合は生石灰や無水の硫酸銅を入れてよく振り水をこれらの物質に吸収させておいて蒸留すると水分のないアルコールが得られます。
蒸留につにいての注意
①フラスコには、液体を2分の1より多く入れないようにする。
②フラスコを熱するときは、直接炎を当てず、金網をして熱する。
③温度計の球の部分はフラスコのえだの付け根のところにあるようにする。
これはコンデンサーに入る蒸気の温度が何度であるかを読むためであって球の部分がえだの位置より低かったり、高かったりすると温度計の示す温度と違う温度の蒸気がコンデンサーに入ることになる。
④沸点が、100℃より低い物質を熱するときは図のように、水浴(ウォーターバス)を使用する。
⑤フラスコの中には、必ず沸騰石を入れる。
これは、加熱によってフラスコの一部分が強熱され突然沸騰し、大きな泡ができて液体がコソデンサーに飛び込まないようにするためである。
なお、一度使った沸騰石は次の蒸留に使うことはできない。
必ず新しい沸騰石を使うようにする。
⑥えだつきフラスコやコンデンサーに使う栓は液体によって溶かされないものを使わなければならない。
有機溶剤を蒸留するときにゴム栓を使うとゴムが有機溶剤に溶けてしまい純粋な有機溶剤を得ることができない。
⑦コンデンサーに入れる水は、下の口から入れ上の口から出すようにする。