ボルタの電池
イオンになりやすいが金属とイオンになりにくい金属をうすい酸の中につけたらどうなるでしょう。
10パーセントぐらいの希硫酸に銅板と亜鉛板とをさし入れただけでは亜鉛板の表面からさかんに水素がでるだけです。
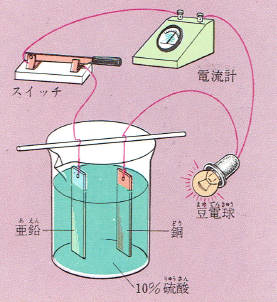
ところが、図のような装置を組み立ててスイッチを押してみると豆電球がつくことがわかります。
また、電流計をつないでみると2つの金属板のあいだに電流が流れていることがわかります。
亜鉛は水素よりイオンになりやすいので電子を残して、亜鉛イオンとなり希硫酸に溶けだします。
亜鉛板に残った電子は、針金を通って自由に動きます。
それで、希硫酸中の水素イオンは銅板から電子を奪って水素となります。
つまり、銅板と亜鉛板をむすぶ針金の中を電子が移動するわけです。
電流の方向は、電子の流れる方向と逆にするという約束がありますのでこの装置では、銅板が陽極、亜鉛板が陰極になります。
このように、イオンの化学変化を利用して電流を生じさせる装置を電池といいます。
希硫酸中に銅板と亜鉛板を入れただけのボルタの電池は銅板の表面に細かい水素の泡がたくさんついて水素イオンが電子とむすびつくのを妨げるため実用になりません。
実用的には、これらの点を改良した、いろいろな電池がつくられています。
乾電池
乾電池は真ん中に炭素棒の陽極があり外側に亜鉛のかんがあって、これが陰極になっています。
乾電池の電極間の電圧は1.5ボルトをしめします。
乾電池の炭素棒は、ボルタの電池の銅板にあたるものです。
亜鉛は亜鉛イオンになって少しずつ減ります。
つまり、電子が余分になった状態になりやすいのですから、陰極になるわけです。
乾電池の中のイオンの動きを考えてみましょう。
陰極においては、ボルタの電池の場合と同じように亜鉛が極に電子を残してイオンになります。
この亜鉛のイオンは、電解液として入っている塩化アンモニウムが電離してできたアンモニウムイオンと反応して化学反応式にあるように錯イオンをつくります。
電解液の中に、亜鉛イオンが増えると亜鉛(陰極)がしだいにイオンになりにくくなりますがこのように錯イオンができるために亜鉛イオンの濃度は増えず、亜鉛のイオン化がすすみます。
また、陽極の炭素のところではやはり、水素イオンが電子を受け取って水素が発生しますが電解液にふくまれる二酸化マンガンと反応して水ができます。
ですから、ボルタの電池のときのように生じた水素ガスが電極の接触を妨げたり、水素が電離して電池の電圧を低くするようなこと(これを分極作用といいます)が起こりません。
乾電池のときに使われる二酸化マンガンなどの酸化剤は分極作用をなくすためのものですから消極剤、または減極剤などとよばれます。